Алюмосиликаты применение в строительстве
Библиографическая ссылка на статью:
Садовникова М.А. Синтезированные алюмосиликаты и их применение в сухих строительных смесях // Современные научные исследования и инновации. 2014. № 11. Ч. 1 [Электронный ресурс]. URL: http://web.snauka.ru/issues/2014/11/40028 (дата обращения: 18.09.2020).
Для регулирования структуры и свойств сухих строительных смесей в их рецептуру вводят различные модифицирующие добавки[1,2,3].
Для расширения рынка модифицирующих добавок для сухих строительных смесей на основе минеральных вяжущих исследовалась возможность получения добавки на основе синтезированных алюмосиликатов. Технология синтеза заключалась в осаждении алюмосиликатов из натриевого жидкого стекла сульфатом алюминия Al2(SO4)3 [4,5]. Добавка представляет собой порошок светлосерого цвета. Удельная поверхность порошка, определенная методом БЭТ, составляет Sуд = 86.5 ± 3.5 м 2 /г.
Микроструктура полученной добавки была изучена с помощью электронного микроскопа при увеличении в 20 000 раз (рис.1). Установлено, что структура добавки представлена, в основном, частицами, размер которых составляет 2,25-8,1нм.

Анализ химического состава добавки выявил высокое содержание химических элементов О, Si и Na, составляющее соответственно 46,47-61,58%, 20,78-39,60% и 5,54-16,52%, что свидетельствует о преобладании оксидов соответствующих элементов.
Для идентификации продуктов синтеза использовался полнопрофильный метод количественного рентгенофазового анализа с применением программы DDMver. 1.95c. Установлено, что концентрация аморфной фазы составляет 77,5%, кристаллическая фаза представлена тенардитом – ромбической модификацией сульфата натрия Na2SO4 и гиббситом [6]..
Анализ гранулометрического состава, выполненный с помощью автоматического лазерного дифрактометра FritschParticleSizerAnalysette 22, показывает, что менее 0,01 % составляют частицы размером 0,010–0,500 мкм, содержание частиц размером 100,000–200,000 мкм составляет 0,44 %. Менее 5 % составляют частицы диаметром 3,226 мкм, менее 15 % – частицы диаметром 6,985 мкм
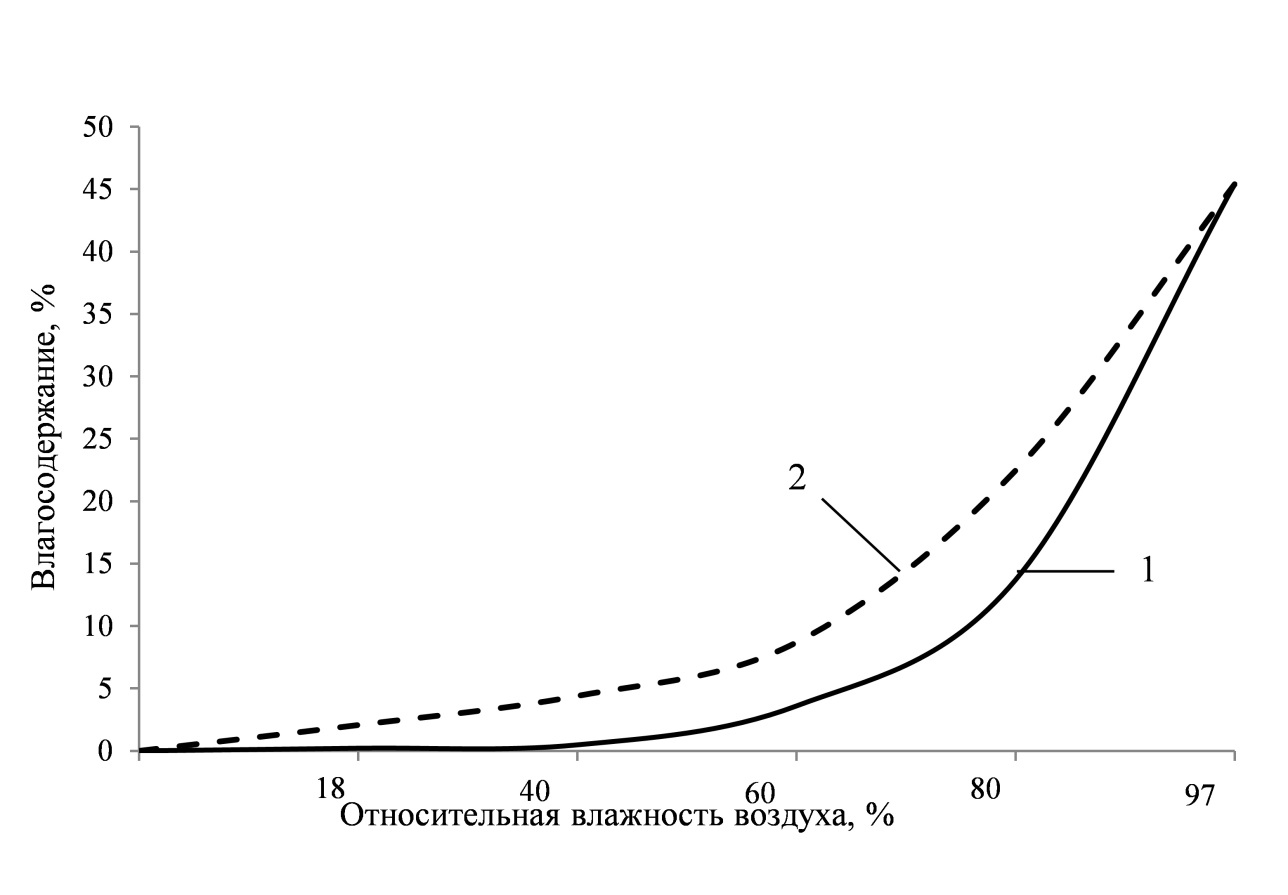
Для оценки сорбционных свойств добавки определялось сорбционное увлажнение. При изучении кинетики сорбции влаги образцы проходили предварительную сушку в сушильном шкафу при температуре t=110 0 С до постоянной массы, помещались в эксикаторы с различной относительной влажностью воздуха φ = 18-97% и постоянной температурой t = 20 + 2 о С. На основании полученных данных были построены изотермы сорбции и десорбции (рисунок 2).
Результаты экспериментальных данных показали, что с увеличением относительной влажности воздуха закономерно возрастает сорбционная влажность, при этом процесс насыщения образцов влагой и влагоотдача описывается S-образными изотермами сорбции и десорбции, характерными для капиллярно-пористых материалов, хорошо смачиваемых водой. Сорбция влаги в интервале значений относительной влажности воздуха до 18% подчиняется закону Генри, т.е. зависимость сорбционного увлажнения от величины относительной влажности воздуха близка к линейной:
Рисунок 2. Изотермы сорбции и десорбции для синтезированных алюмосиликатов
1-изотерма сорбции; 2-изотерма десорбции.
При повышении относительной влажности воздуха до 40% влагосодержание в образцах увеличивается в соответствии с уравнением Фрейндлиха [7]. Выпуклая часть изотерм (φ = 60-80%) указывает на присутствие внутри исследуемых образцов только адсорбированной влаги, состоящей из одного слоя молекул водяного пара. Повышение относительной влажности воздуха до 90% приводит к образованию на внутренней поверхности материала пленок адсорбированной влаги, состоящих из многих слоев молекул. Начиная с 80%-ной влажности происходит резкое возрастание сорбционного увлажнения, что свидетельствует о протекании процесса капиллярной конденсации [8].
Изотермы сорбции и десорбции совпадают только при очень малых и очень больших значениях относительной влажности воздуха, при других значениях – не совпадают. Изотермы сорбции располагаются ниже, чем изотермы десорбции и равновесное влагосодержание при одинаковом значении относительной влажности воздуха при десорбции влаги меньше, чем при сорбции влаги.
Синтезируемые алюмосиликаты предложено применять при изготовлении известкового композиционного вяжущего. Композиционное известковое с применением синтезированных алюмосиликатов характеризуется более быстрым отверждением по сравнению с чисто известковым вяжущим. Так, пластическая прочность теста прочность в возрасте 10 часов с момента затворения на основе композиционного вяжущего составляет t =0,024 МПа,а на основе чисто известкового вяжущего t=0,0012 МПа.
Предлагается применять такое вяжущее при изготовлении сухих строительных смесей, предназначенных для реставрации зданий исторической застройки, а также отделки вновь возводимых объектов.
Известковые составы на основе композиционного вяжущего характеризуются хорошей удобоукладываемостью, отсутствием трещинообразования. Время высыхания до степени 5 составляет 15-20 минут, прочность сцепления с растворной подложкой -0,6-1,2МПа.
Библиографический список
- Логанина В.И. Известковые отделочные составы на основе золь-гель технологии/ В.И. Логанина, О.А. Давыдова// Строительные материалы. – 2009 – № 3. – С.50-51
- Логанина В.И. Оптимизация составов композитов общестроительного назначения, модифицированных наноразмерными добавками/ В.И. Логанина, Л.В. Макарова, Р.В. Тарасов, О.А. Давыдова// Региональная архитектура и строительство . – 2010.- № 2 . – С. 53-57.
- Логанина В.И. Эффективность применения в сухих строительных смесях органоминеральных добавок на основе смешанослойных глин/ В.И. Логанина, С.Н. Кислицына, В.В. Черячукин, Э.Р. Акжигитова// Региональная архитектура и строительство . –2012.- № 3 . – С. 57-60.
- Логанина В.И. Добавка на основе синтезированных алюмосиликатов для цементных систем/ В.И. Логанина, И.В. Жерновский, М.А. Садовникова, К.В. Жегера// Восточно-Европейский журнал передовых технологий . –2013. Т. 5.- № 6 (65) . – С. 8-11.
- Логанина В.И. Реологические свойства композиционного известкового вяжущего с применением синтетических цеолитов/ В.И. Логанина, С.Н. Кислицына, Л.В. Макарова, М.А. Садовникова//Известия высших учебных заведений. Строительство. – 2013. – №4(652). – С.37-42.
- Solovyov L.A., includes rietveld and derivative difference minimization (DDM) methods. J. Appl. Cryst. 37, 2004. – Pp. 743-749
- Лопаткин, А. А. Теоретические основы физической адсорбции / А. А. Лопаткин. – М.: Изд-во Моск. Ун-та, 1983. – 339 с.
- Гельфман, М. И. Коллоидная химия / М. И. Гельфман, О. В. Ковалевич, В. П. Юстратов. – спб.: Лань, 2008. – 336 с
Количество просмотров публикации: Please wait
Связь с автором (комментарии/рецензии к статье)
Оставить комментарий
Вы должны авторизоваться, чтобы оставить комментарий.
Алюмосиликат

Получение алюмосиликата и его свойства
Алюмосиликат имеет вид мелкого порошка желтовато-белого оттенка, не имеющего запаха, нерастворимого в воде, но разлагающегося при взаимодействии с фтористоводородной кислотой.
Алюмосиликатами являются шпаты полевого типа (альбит, ортоклаз и т.д.), слюда и минералы глинистого типа.
Широкое применение алюмосиликаты получили в пищевой промышленности, где наиболее эффективно проявляются их свойства, направленные на препятствие к скатыванию и комкованию пищевых продуктов и ингредиентов. Также данное соединение обладает свойствами осветления и разделения сыпучих продуктов.
Алюмосиликат имеет характерный земляной привкус, не имеет примесей и может быть скомбинирован с другими видами силикатов.
Применение алюмосиликата
В пищевой промышленности алюмосиликат маркируется как пищевая добавка Е 559 и используется в сухих продуктах, порошках и смесях.
Применяют алюмосиликат при изготовлении сухих молочных продуктов (молоко, сливки и т.д.), а также сахарного песка, сахарной пудры, пищевой соли, пряностей и приправ. Этот силикат может входить в состав заменителя соли с подобными натуральному продукту свойствами.
Данный эмульгатор добавляют в состав сыров, а также в сырные полуфабрикаты, которые в нарезанном виде заворачивают в фольгу.
В соответствии с технологическими инструкциями и санитарно-эпидемиологическими нормами пищевая добавка Е 559 может входить в состав БАДов, сахарных таблеток, кондитерских изделий и консервированных продуктов.

В Европе применяют алюмосиликаты в медицинских и косметических целях. Их добавляют в мази и лечебные гели, белую глину, лекарственные препараты и крема. Алюмосиликат может содержаться в кормах и витаминных добавках для животных и птиц.
В качестве вспомогательного средства данные силикаты применяют при изготовлении упаковок, пакетов и бумажных изделий.
Противопоказания и ограничения в использовании
Алюмосиликаты необходимо употреблять в строго ограниченном количестве, так как они могут нанести серьезный вред здоровью человека. Использование в пищевой промышленности этой добавки разрешено во многих странах Европы, в том числе в Англии, России, Франции, Украине и т.д.
Нашли ошибку в тексте? Выделите ее и нажмите Ctrl + Enter.
В четырех дольках темного шоколада содержится порядка двухсот калорий. Так что если не хотите поправиться, лучше не есть больше двух долек в сутки.
При регулярном посещении солярия шанс заболеть раком кожи увеличивается на 60%.
По статистике, по понедельникам риск получения травм спины увеличивается на 25%, а риск сердечного приступа – на 33%. Будьте осторожны.
В нашем кишечнике рождаются, живут и умирают миллионы бактерий. Их можно увидеть только при сильном увеличении, но, если бы они собрались вместе, то поместились бы в обычной кофейной чашке.
Раньше считалось, что зевота обогащает организм кислородом. Однако это мнение было опровергнуто. Ученые доказали, что зевая, человек охлаждает мозг и улучшает его работоспособность.
Существуют очень любопытные медицинские синдромы, например, навязчивое заглатывание предметов. В желудке одной пациентки, страдающей от этой мании, было обнаружено 2500 инородных предметов.
Упав с осла, вы с большей вероятностью свернете себе шею, чем упав с лошади. Только не пытайтесь опровергнуть это утверждение.
Для того чтобы сказать даже самые короткие и простые слова, мы задействуем 72 мышцы.
Люди, которые привыкли регулярно завтракать, гораздо реже страдают ожирением.
Согласно исследованиям ВОЗ ежедневный получасовой разговор по мобильному телефону увеличивает вероятность развития опухоли мозга на 40%.
Согласно исследованиям, женщины, выпивающие несколько стаканов пива или вина в неделю, имеют повышенный риск заболеть раком груди.
Кариес – это самое распространенное инфекционное заболевание в мире, соперничать с которым не может даже грипп.
Если бы ваша печень перестала работать, смерть наступила бы в течение суток.
Многие наркотики изначально продвигались на рынке, как лекарства. Героин, например, изначально был выведен на рынок как лекарство от детского кашля. А кокаин рекомендовался врачами в качестве анестезии и как средство повышающее выносливость.
Желудок человека неплохо справляется с посторонними предметами и без врачебного вмешательства. Известно, что желудочный сок способен растворять даже монеты.
Об ортокератологических линзах (их еще называют жесткими ночными линзами) сегодня еще мало кто знает. Этот метод исправления рефракции глаза самый новый из всех.
АЛЮМОСИЛИКАТЫ
АЛЮМОСИЛИКАТЫ – природные и синтетические силикаты, содержащие в составе сложных анионов атомы алюминия и кремния.
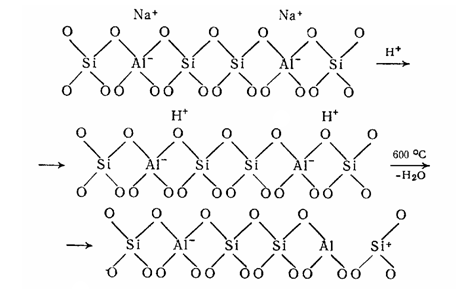
Русский ученый Дмитрий Иванович Менделеев первым высказал идею, что алюмосиликаты представляют собой «неопределенные соединения», такие, например, как сплавы, но не простых тел, а близких по своим свойствам оксидов SiO2 и Al2O3. Сам термин «алюмосиликаты» был введен в минералогию Владимиром Ивановичем Вернадским, впервые правильно оценившим роль алюминия в построении минералов. В 1890-е он приступил к созданию своей теории строения алюмосиликатов. Как и Д.И.Менделеев, он говорил о близости химических функций оксидов кремния и алюминия. Отвергал мысль о том, что алюмосиликаты есть соли кремниевых кислот. По его мнению, алюмосиликаты являются производными сложных алюмосиликатных радикалов, «каолиновых ядер». Гипотеза о «каолиновом ядре» как о замкнутой группировке атомов кремния, алюминия и кислорода оказалась актуальной при расшифровке структуры полевых шпатов.
К началу 20 в. был накоплен обширный экспериментальный материал по составу и свойствам алюмосиликатов, однако их строение все еще оставалась загадкой. Решающее влияние на изучение структуры алюмосиликатов оказало открытие в 1912 немецкими физиками Максом фон Лауэ, Пaулем Книппингом (Knipping Paul) (1883–1935) и Вальтером Фридрихом (Friedrich Walter) (1883–1968) явления дифракции рентгеновских лучей на кристаллах и создание Уильямом Генри (Bragg William Henry) (1862–1942) и Уильямом Лоуренсом (Bragg William Lawrence) (1890–1971) Брэггами на этой основе принципиально нового метода исследования вещества – рентгеноструктурного анализа.
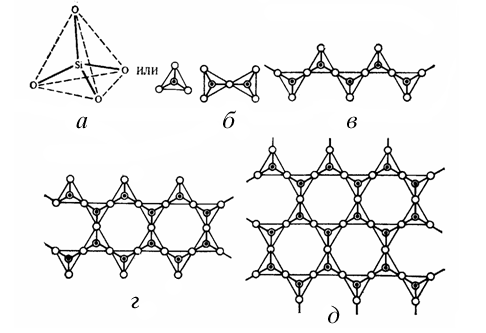
С 1925 по 1931 проводились интенсивные рентгеноструктурные исследования силикатов и алюмосиликатов и было установлено, что основным «строительным кирпичиком» этих соединений является атом кремния или алюминия, окруженный четырьмя атомами кислорода, – кремне(алюмо)кислородный тетраэдр SiO4(AlO4). Многообразие же алюмосиликатов объясняется разными способами соединения этих тетраэдров, которые обычно сочленяются вершинами с образованием связей Si-O-Si и Si-O-Al (рис. 1).
Алюмосиликаты распространены в природе, они составляют до 50% массы земной коры. К природным алюмосиликатам относятся, в первую очередь, полевые шпаты, имеющие каркасную структуру (например ортоклаз NaAlS3O8, альбит NaAlSi3O8, анортит CaAl2Si2O8).
У каркасных алюмосиликатов – непрерывный трехмерный каркас из тетраэдров, объединенных общими вершинами. Случаи связывания гранью или ребром неизвестны. Все атомы кислорода у тетраэдров кремния и алюминия являются общими. Так как в целом соединение должно быть электронейтральным, то полости между полиэдрами дополнительно заполняются катионами, которые нейтрализуют отрицательный заряд каркаса, возникающий при замене кремния на алюминий.
Каркасные алюмосиликаты являются основой многих поделочных камней. Такими алюмосиликатами являются и некоторые драгоценные камни, например берилл (Be3Al2)Si6O18 и его окрашенные разновидности: аквамарин (голубой, примесь оксида железа) и изумруд (зеленый, примесь оксида хрома). Полевые шпаты в составе различных горных пород, например, гранита, применяются в строительстве. Синтетические алюмосиликаты, полученные нагреванием оксидов алюминия и кремния с оксидами металлов, образуют основную кристаллическую фазу керамических материалов.
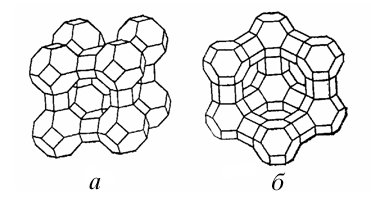
В 18 в. были открыты цеолиты – каркасные алюмосиликаты, состав которых можно описать общей формулой M I xM II y(Alx+2ySizO2x+4y+2z)·nH2O. Свое название они получили от греческих слов zeo – киплю и lithos – камень, т.к. образуют пузырчатое стекло при сильном и быстром нагревании. Известно более 40 минеральных видов природных цеолитов. Всего в мире известно около 1000 крупных месторождений цеолитов более чем в 40 странах, из них в России – около 20 (в Кузбассе, Якутии, Бурятии, Приморье, на Камчатке и о.Сахалин). С 1950-х в промышленных масштабах производятся искусственные цеолиты. В лабораториях синтезировано более 100 структурных видов, большинство которых не имеют природных аналогов.
Цеолиты – это нестехиометрические соединения, их составы изменяются в широких пределах, образуя ряды твердых растворов. Кристаллические структуры цеолитов состоят из тетраэдров [SiO4] 4– и [АlO4] 5– , соединенных вершинами в ажурные каркасы, в полостях и каналах которых находятся катионы металлов и молекулы Н2О. Они характеризуются рыхлой структурой с широкими каналами (рис. 2).
Это позволяет им обменивать находящиеся в полостях решетки катионы металлов и молекулы воды. Натуральные и синтетические цеолиты широко применяются в качестве катионообменников, например, при умягчении воды.
Если из цеолитов полностью удалить адсорбированную в их полостях воду, они выступают в роли молекулярных сит: в освободившихся полостях могут селективно адсорбироваться молекулы диоксида углерода, аммиака и других веществ. Поэтому цеолиты применяются как адсорбенты в хроматографии, а также при очистке, осушке и разделении газов.
Цеолиты являются кислотными катализаторами. Подвижные катионы, например, катионы натрия при промывке цеолита растворами кислот обмениваются на катионы водорода с образованием кислот Бренстеда. Если такой цеолит нагреть, вода может покинуть кислотные центры Бренстеда, и останутся атомы алюминия, координированные только с тремя атомами кислорода (рис. 3).
Продукт реагирует как кислота Льюиса. Преимущество цеолитов по сравнению с другими катализаторами в том, что появившиеся каталитические центры многочисленны, равномерно распределены по каркасу и одинаковы по активности.
Многие цеолиты используются как носители катализаторов.
Еще одна группа каркасных алюмосиликатов – это ультрамарины, встречающиеся в природе в виде сине-зеленого минерала лазурита (Na,Ca)8(Al,Si)12O24(S,SO4). Они отличаются от полевых шпатов и цеолитов открытой решеткой и интенсивной окраской. В отличие от других каркасных силикатов, ультрамарины безводны и содержат различные анионы: полисульфиды, сульфаты, хлориды. Считают, что синяя окраска ультрамаринов обусловлена наличием анион-радикалов S3 – , зеленая – присутствием S3 – и S2 – , а красная – S4 – .
Разложение каркасных алюмосиликатов на поверхности Земли и их превращение в слоистые силикаты (глины и другие отложения) сопровождается огромными по масштабам эффектами связывания энергии. В связи с этим алюминию приписывается роль основного аккумулятора солнечной энергии в земной коре.
Горные породы любого типа: кристаллические, обломочные, глинистые и аморфные на поверхности литосферы разрушаются, поглощая солнечную энергию. Такой процесс часто называют выветриванием, хотя ветер участия в нем не принимает.
Обычно процесс начинается с физического дробления. При разрушении минералов вещество горных пород поглощает солнечную энергию, идущую на увеличение площади свободной поверхности.
Биохимическое разложение выражается в разрушении структуры минералов с образованием новых минералов (большей частью, глинистых), устойчивых в поверхностных условиях литосферы. В нем в той или иной степени принимают участие организмы как непосредственно, так и опосредствовано – через продукты своей жизнедеятельности (почвообразование (см.также ПОЧВЫ), свободный кислород, растворенные в водах органические кислоты и др.).
Например, кристаллический алюмосиликат альбит NaAlSi3O8 разрушается до аморфного опала – гидрооксида кремния SiO2·nH2O и глинистого минерала – каолинита состава Al2O3·2SiO2·2H2O. Переход кристаллических веществ в аморфные и тонкодисперсные сопровождается повышением энергонасыщенности вещества, т.к. расстояние между атомами в нем увеличивается. Происходит и геохимическая аккумуляция солнечной энергии, так как в полевых шпатах координационное число алюминия 4, а в образовавшихся за счет их глинистых минералах оно повышается до 6.
В слоистых алюмосиликатах кремне- и алюмокислородные тетраэдры соединены в одной плоскости в непрерывный слой. Слои тетраэдров обособлены друг от друга. Связь между слоями обеспечивается ван-дер-ваальсовыми силами или силами электростатического притяжения с помощью катионов, нейтрализующих отрицательные заряды слоев. Из-за наличия слоев тетраэдров и слабых связей между ними слоистые алюмосиликаты образуют чешуйчатые, листовые или таблитчатые агрегаты.
К слоистым алюмосиликатам относятся некоторые глинистые минералы, например галлуазит (H2O)4[Al2(Si2O5)(OH)4]. Все такие минералы содержат между слоями решетки молекулы воды. В некоторых из них, например, вермикулите (Ca,Mg)0,7(Mg,Fe III ,Al)6(Al,Si)8O20·8H2O, вода быстро удаляется при нагревании, и минерал расслаивается. Обезвоженный вермикулит применяют в качестве легкого наполнителя при изготовлении бумаги, пластиков и красок, а также как упаковочный материал.
В увлажненном состоянии глины (состоящие из частиц размером менее 0,001 мм) пластичны. При высыхании они сохраняют приданную им форму, а при обжиге твердеют. Их используют для очистки различных продуктов (нефти, масел, вод и пр.), обезжиривания тканей, при производстве железорудных окатышей, керамзита, в литейном деле, медицине, изготовлении мыла, простого и огнеупорного кирпича, фаянса и других изделий.
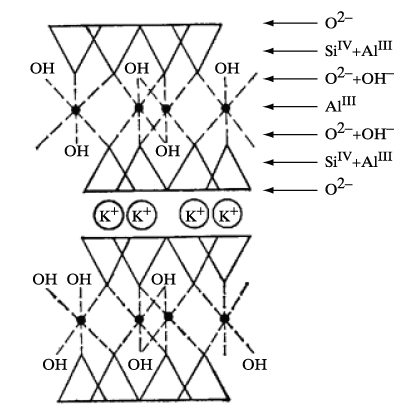
Минералы группы слюд образуют слоистую решетку с ионами «гостей» между силикатными листами «хозяина» (рис. 4).
Слюды легко расщепляются на очень тонкие, гибкие и в то же время упругие пластинки. Они обладают высокими диэлектрическими свойствами и огнестойкостью. В виде тонких пластин они прозрачны, поэтому было время, когда их использовали в качестве оконного стекла. Сейчас, благодаря высоким диэлектрическим свойствам, слюды применяются в электропромышленности, радиотехнике и приборостроении.